PRACTICA DE TINCION DIFERENCIAL GRAM
&Objetivos de la practica
- Visualizar diferentes tipos bacterianos en funcion de su distinta composicion de su pared bacteriana
- Visualizar su morfologia y disposicion
Fundamento
Es el metodo mas empleado en bacteriologia gracias al cual las bacterias se pueden clasificar en dos grandes grupos. Este distinto comportamiento en la tincion de Gram es debido a la distinta composicion de la pared de las células bacterianas. De acuerdo con esto, la tincion de gram se va a basar en el empleo de un primer colorante básico, generalmente cristal violeta o violeta de genciana, que teñira de color azul todas las bacterias. Posteriormente, un mordiente, el lugol, aumentara la afinidad del primer colorante a las células, es decir, lo fijara.
Finalmente, un agente decolorante decolorará solamente un tipo de bacterias que seran teñidas con el colorante de contraste. Este distinto comportamiento frente a la decoloración es segundo colorante. Este distinto comportamiento frente a la decoloración es dependiente de la composición de la pared bacteriana, hecho que servira para clasificarlas como Gram + (aquellas que no han sido decoloradas y que por lo tanto quedaran teñidas con el cristal violeta) o como Gram- que seran aquellas bacterias que han sido decoloradas y son teñidas con el colorante de contraste, la safranina.
Materiales
- Portaobjetos
- Asa de siembra
- Mechero bunsen
- Pipeta Pasteur
- Cristalizador
- Barras paralelas
- Frasco lavador
- Muestra problemas (Saliva y Actimel)
- Aceite de inmersion
- Colorantes (Cristal violeta, lugol, Alcohol 96% y safranina)
Procedimiento

- Comenzamos con la fijacion de las muestras en el porta. Con el mechero bunsen en funcionamiento colocamos una gota de suero en el porta y colocamos la muestra sobre la gota de suero realizando el frotis. Con ayuda del mechero damos pasadas para la fijacion de la muestra en el porta.
2. A continuacion colocamos los portaobjetos con la muestra ya fijada sobre las barras paralelas que se encontraran encima del cristalizador para recoger los liquidos que caigan.
3. Comenzamos a aplicar sobre el portaobjetos los colorantes.
-El primer colorante sera cristal violeta, durante 1 min
Lavamos con abundante agua destilada sin dar directamente sobre la muestra.
-Aplicamos el mordiente, el lugol, que actuara fijando el colorante anterior a las bacterias, durante 1 minuto. Se vuelve a lavar el exceso mediante agua destilada.
-Decoloramos con alcohol durante unos 30 segundos y volvemos a lavar.
-Cubrimos el portaobjetos con el segundo colorante de contraste, Safranina, durante 2 minutos y lavamos
Secamos las muestras y comenzamos la visualización.
Visualización:
Saliva
Actimel
Interpretacion de Resultados: Se aprecian coloraciones rosaceas en las celulas, indicatibo de que estas bacterias corresponden a Gram -
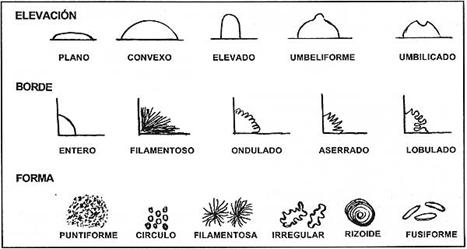 .
.